phasen der arzneimittelzulassung
Die Entwicklung und Zulassung einer Impfung durchläuft normalerweise folgende Schritte:
1. Erreger erforschen
Der Erreger muss vor Entwicklung einer Impfung so genau wie möglich erkannt werden. Molekularbiolog:innen, Virolog:innen, Mediziner:innen und andere Wissenschaftler:innen wissen am Ende dieses Arbeitsschrittes in der Regel mehr über den Krankheitserreger, den sie erforscht haben, als über ihre Partner:innen, die monate- oder gar jahrelang in dieser Forschungszeit alleine zu Abend gegessen haben.
2. Wirkstoff herstellen, Patent anmelden
Entweder chemisch oder gentechnisch muss der Wirkstoff der Impfung hergestellt werden. Dieses Kochrezept muss patentiert werden, bevor die Wirksamkeit des Produktes an lebenden Organismen getestet werden kann. In Vitro, also auf Zellebene im Reagenzglas, können aber bereits erste Aussagen über den Wirkstoff getroffen werden.
Um sich eine Vorstellung von der Arbeitsdauer zu machen: Solche Aufgabenstellungen sind normalerweise Themen für eine Promotions- oder Habilitationsarbeit. Diese dauert im Regelfall etwa drei Jahre, in vielen Fällen aber auch länger.
3. Tierversuche und klinische Studien
In der Pharmazie kann man (noch) keinen Säugetierorganismus digital simulieren. Aus Menschenrechtsgründen müssen daher zuerst verschiedene Tierversuche an gesunden, männlichen, weiblichen, trächtigen und erkrankten Säugetieren durchgeführt werden, die im Gesamtbild ergeben müssen, dass das Arzneimittel kein höheres Gesundheitsrisiko birgt als die Erkrankung, gegen die es eingesetzt wird. Dann erst darf das Arzneimittel Menschen verabreicht werden. In diesem ersten Schritt kann man oft auch bereits erahnen, wie wirksam der Wirkstoff gegenüber den Symptomen oder im Falle der Impfung gegenüber dem Erreger selbst ist.
Ist diese Phase abgeschlossen, folgen vier klinische Phasen, von denen drei bereits vor der Markteinführung erfolgreich absolviert werden müssen.
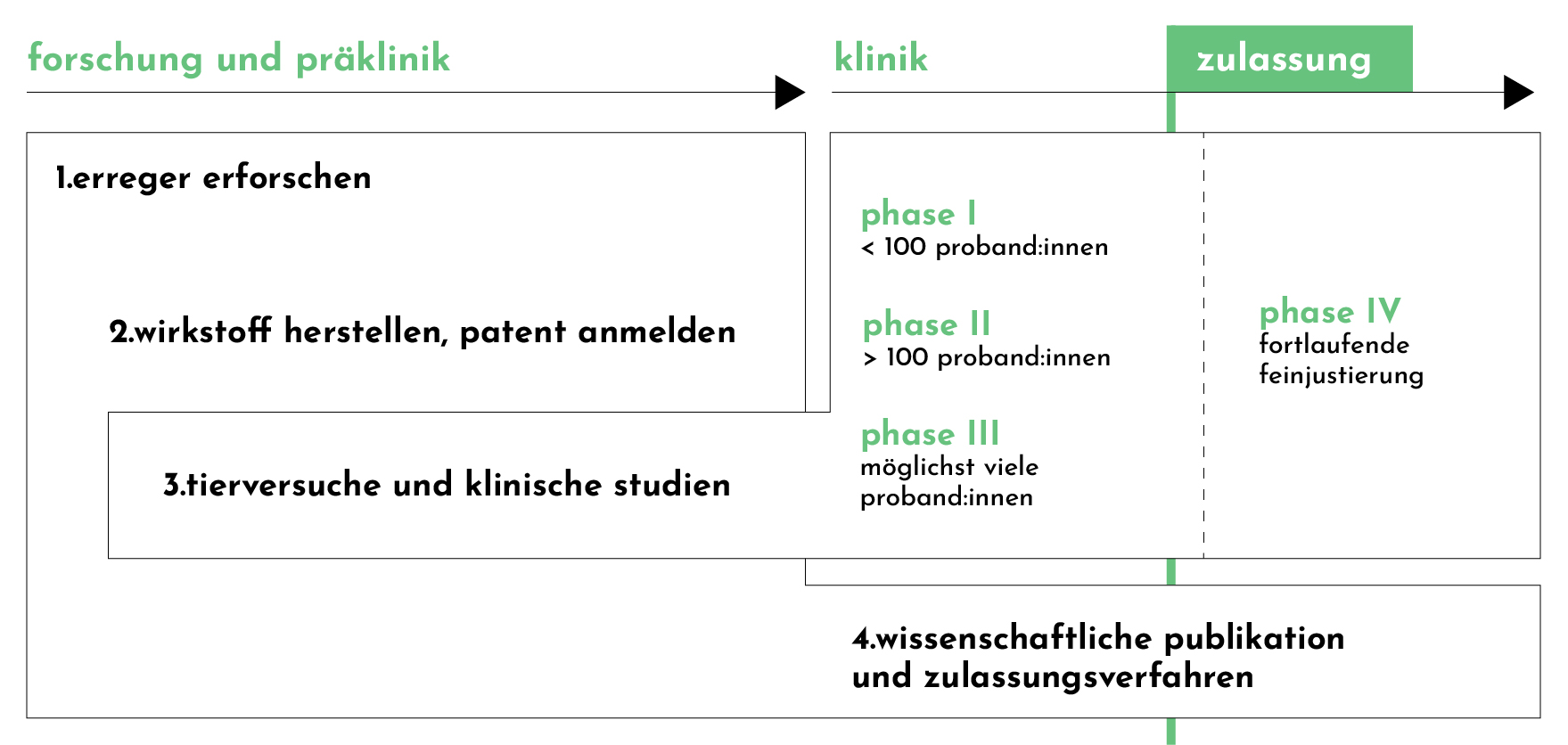
Phase I
Testung an gesunden (hauptsächlich männlichen) Proband:innen
In der ersten Phase der klinischen Tests wird festgestellt, ob das Medikament verträglich und sicher ist. Meist wird parallel der Abbauprozess im menschlichen Stoffwechsel untersucht.
Phase II
Testung an gesunden und erkrankten Proband:innen (Anzahl der Teilnehmenden muss über 100 liegen und die Studie wird in der Regel parallel an mehreren Orten durchgeführt) unter den Gesichtspunkten der Wirksamkeit, der Nebenwirkungen sowie der optimalen Dosierung.
Phase III
Testung an einem größeren Patient:innenkollektiv (je nach Häufigkeit der Erkrankung variiert die Stichprobengröße extrem, aber es sind in der Regel mehrere hundert bis mehrere tausend Teilnehmende involviert), um Wirksamkeit und Nebenwirkungen empirisch abschätzen zu können.
Es handelt sich in der Regel um sogenannte “randomiserte Doppelblindstudien”, in denen ein Teil der Proband:innen den Wirkstoff erhält, ein anderer Teil eine Blindprobe – ein sogenanntes Placebo. Weder Ärzt:in noch Proband:in wissen vor Ende der Studie, welches Präparat verabreicht wird. Auf diese Weise soll eine profitorientierte oder persönlich motivierte Manipulation des Studienergebnisses verhindert werden. Die Dauer der Phase III-Studien ist ebenfalls unterschiedlich. Um Spätfolgen realistisch abschätzen zu können, sollten sie aber nicht allzu kurz gehalten werden, also durchaus in Einzelfällen mehrere Jahre andauern.
Phase IV
Die vierte Phase findet nach Markteinführung statt und dient als eine Art “Feinjustierung” der Anwendung und der pharmakologischen Eigenschaften des Wirkstoffs. Alle klinischen Studien in Deutschland und anderen europäischen Ländern durchlaufen vor ihrer Umsetzung eine Prüfung durch eine staatliche Ethikkommission und müssen die in der Deklaration von Helsinki festgehaltenen Voraussetzungen zur Sicherstellung menschenwürdiger Bedingungen erfüllen. Da in jeder Studie kleine Fehler passieren, die das Ergebnis verzerren, wird ein Ergebnis erst dann als gültig erklärt, wenn mehrere Studien dasselbe Fazit ergeben haben.
Wie in unserem Artikel zur “Gender Data Gap” nachzulesen, sind die Teilnehmenden bei klinischen Studien in der Regel weiße Männer im Alter zwischen 18 und 70 Jahren, alle anderen Menschen innerhalb der Studie werden als “Subgruppen” geführt. Frauen und einzelne demografische Gruppen sind fast immer unterrepräsentiert. Die Effekte des jeweiligen Wirkstoffs auf schwangere Menschen und deren ungeborene Kinder sind oftmals bis zur Markteinführung unbekannt.
4. Wissenschaftliche Publikation und Zulassungsverfahren
Am Ende einer Studie wird diese ausgewertet und in Fachzeitschriften, Datenbanken und Fachliteratur publiziert. Im Vorfeld wird die formale und wissenschaftliche Korrektheit im obligatorischen Lektorat durch von den Autor:innen unabhängige Fachkolleg:innen überprüft. Dann kann ein Zulassungsantrag gestellt werden.

Elisabet Bästlein
Redaktionsleitung
Elisabet studiert pharmazeutische Chemie. Vor ihrer Studienzeit war sie als freie Journalistin in der Kreisredaktion Nordfriesland des Schleswig-Holsteinischen Zeitungsverlages (sh:z) tätig.

Trackbacks/Pingbacks